

来源:贵阳执业医师培训学校
时间: 2018/8/9 16:07:31
距考试仅剩70天的时间,想必不少考生已经着手复习法规了。这里对法规中的药品生产管理的相关考点做了个总结,希望对考生有帮助。
考点一、药品生产许可(2015,B)(2017,A)共2分
1.药品生产、经营企业开办条件

2.药品生产
(1)生产记录必须完整准确;
(2)改变影响药品质量的生产工艺的,必须报原批准部门审核批准。
3.中药饮片的炮制规定
(1)必须按照“药品”标准炮制;
(2)没有“国标”的,必须按照“省级药监部门”制定的炮制规范炮制;
(3)“省级药监部门”制定的炮制规范应当报“国药监部门备案”。
4.生产药品所需的原料、辅料,必须符合“药用要求”。
提示:直接接触药品的包装材料和容器必须符合:药用要求。
5.药品生产许可的申请和审批
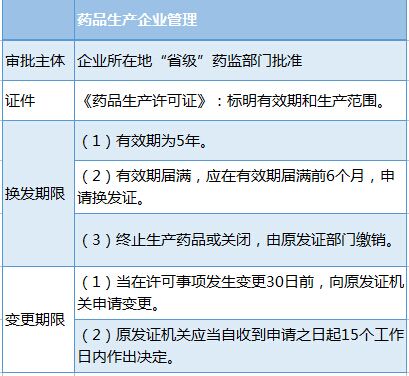
(1)开办药品生产企业,须经“企业所在地”“省级食药监部门”批准并发给《药品生产许可证》;
(2)药品生产企业将部分“生产车间分立”,形成独立药品生产企业的,应按规定办理《药品生产许可证》;
(3)新开办药品生产企业、药品生产企业新建药品生产车间或者新增生产剂型的,应当自取得药品生产证明文件或者经批准正式生产之日起30日内,按照规定要求申请《药品生产质量管理规范》认证。
6.药品生产许可证管理
考点二、《药品生产质量管理规范》及其认证(2015,A)(2016,A)共2分
1.药品生产企业,为增加生产质量管理的基本要求上,必须配备所需的资源,至少包括:
(1)具有适当的资质并经培训合格的人员;
(2)足够的厂房和空间;
(3)适用的设备和维修保障;
(4)正确的原辅料、包装材料和标签;
(5)经批准的工艺规程和操作规程;
(6)适当的贮运条件。
2.机构与人员要求
(1)企业应当设立独立的质量管理部门,履行质量增加和质量控制的职责。
(2)质量管理部门可以分别设立:质量增加部门和质量控制部门。
(3)关键人员应当为企业的全职人员,至少应当包括:企业负责人、生产管理负责人、质量管理负责人和质量受权人。
①质量管理负责人和生产管理负责人不得互相兼任。
②质量管理负责人和质量受权人可以兼任。
③应当制定操作规程确保质量受权人独立履行职责,不受企业负责人和其他人员的干扰。
3.文件管理的规定
(1)每批药品应当有“批记录”;
提示:包括批生产记录、批包装记录、批检验记录和药品放行审核记录等与本批产品有关的记录。
(2)批记录应当由“质量管理部门”负责管理,至少保存至“药品有效期后一年”;
(3)质量标准、工艺规程、操作规程、稳定性考察、确认、验证、变更等其他重要文件应当“长期保存”。
4.生产管理的要求
(1)建立划分产品生产批次的操作规程,生产批次的划分应当能够确保“同一批次产品质量和特性的均一性”;
(2)每批药品均应当编制的批号;
(3)生产日期不得迟于产品成型或灌装(封)前经后混合的操作开始日期;
(4)不得以产品包装日期作为生产日期;
(5)不得在同一生产操作间同时进行不同品种和规格药品的生产操作,除非没有发生混淆或交叉污染的可能。
5.GMP认证申请
(1)新开办药品生产企业、新增生产范围、新建车间的,应当按照《药品管理法实施条例》的规定申请药品GMP认证;
(2)已取得《药品GMP证书》的药品生产企业应在“证书有效期届满前6个月”,重新申请药品GMP认证;
提示:《药品GMP证书》有效期5年。
提示:《药品GMP证书》有效期内至少进行一次跟踪检查。
(3)药品生产企业改建、扩建车间或生产线的,应重新申请药品GMP认证。
6.现场检查
(1)现场检查实行“组长负责制”,检查组一般由不少于3名药品GMP检查员组成,从药品GMP检查员库中随机选取,并应遵循回避原则;
(2)药品认证检查机构应在现场“检查前”通知申请企业;
(3)现场检查时间一般为3—5天,可根据具体情况适当调整;
(4)现场检查结束后,检查组应对现场检查情况进行:分析汇总,并客观、公平、公正地对检查中发现的缺陷进行风险评定。
(5)检查缺陷的风险评定应综合考虑产品类别、缺陷的性质和出现的次数。缺陷分为:
①严重缺陷:指与药品GMP要求有严重偏离,产品可能对使用者造成危害的。
②主要缺陷:指与药品 GMP要求有较大偏离的。
③一般缺陷:指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的。
以上由贵阳执业药师培训学校整理,如果您在此过程中遇到任何疑问,可以和我们贵阳执业药师的老师在线沟通QQ交谈。